La photogrammétrie subaquatique pour l’étude des habitats en cours d’eau
La dégradation des habitats aquatiques représente une menace majeure pour de nombreuses espèces, et leur étude reste complexe. Cet article présente une méthode innovante basée sur la photogrammétrie subaquatique, une approche non invasive et non destructive, pour caractériser précisément les substrats des cours d’eau. Appliquée à l’écologie des larves de lamproies, cette technique offre de nouvelles perspectives pour comprendre la spécificité de leur habitat et contribuer à leur préservation dans un contexte de forte anthropisation des cours d’eau.
Contexte et objectifs
Les écosystèmes d’eau douce font partie des plus importants réservoirs de biodiversité de la planète. Cependant, ils font face au plus rapide et fort déclin de biodiversité comparés aux autres écosystèmes (Dudgeon et al., 2005). Ce constat alarmant est majoritairement lié à une dégradation massive des habitats (IPBES, 2019)
Mise au point du protocole en conditions contrôlées
La photogrammétrie consiste à prendre des photos d’un objet ou d’une scène (« patch » dans la suite du texte) sous plusieurs angles de vue avec une caméra, utilisant la parallaxe obtenue entre les images acquises pour reconstituer une vue 3D du patch. Le patch est délimité par des cibles appelées points de contrôle au sol (Ground Control Point ; GCP) permettant un géoréférencement et une meilleure reconstruction des nuages de points (figure 1a). Toutes les photos sont triées afin de retirer celles de mauvaise qualité (e.g., floues, surexposées) ou présentant des objets flottants dans la colonne d’eau (e.g., débris, branches). Elles sont ensuite assemblées deux à deux à l’aide du logicel Agisoft Metashape v1.6.1 (Agisoft LLC, Russia) pour reconstituer le patch sous la forme d’un nuage de points en 3D. Tous les GCP sont identifiés sur les photos dans le logiciel Agisoft et nous y renseignons aussi les distances entre chaque GCP ainsi que les hauteurs d’eau au-dessus de chaque GCP (figure 1a). Cela permet un géoréférencement relatif de notre patch afin d’obtenir une précision de l’ordre du millimètre.
Une première phase de test en bassin contrôlé nous a permis de tester la méthode dans différentes conditions de profondeurs et de turbidité (simulée à l’aide de concentration de lait +/– importante ; figure 1b). Les premiers essais effectués à l’aide d’une seule caméra dirigée au bout d’une perche flottante ont rapidement montré leur limite. Ces essais nous ont aussi montré que plus la turbidité de l’eau augmente, plus le nuage de point est difficile à obtenir (figure 1b). Il en va de même avec la hauteur d’eau : moins il y a d’eau au-dessus du patch, plus il sera difficile d’obtenir un nuage de point correct. Cela s’explique par le très faible champ de vision de la caméra induit par la faible hauteur d’eau.
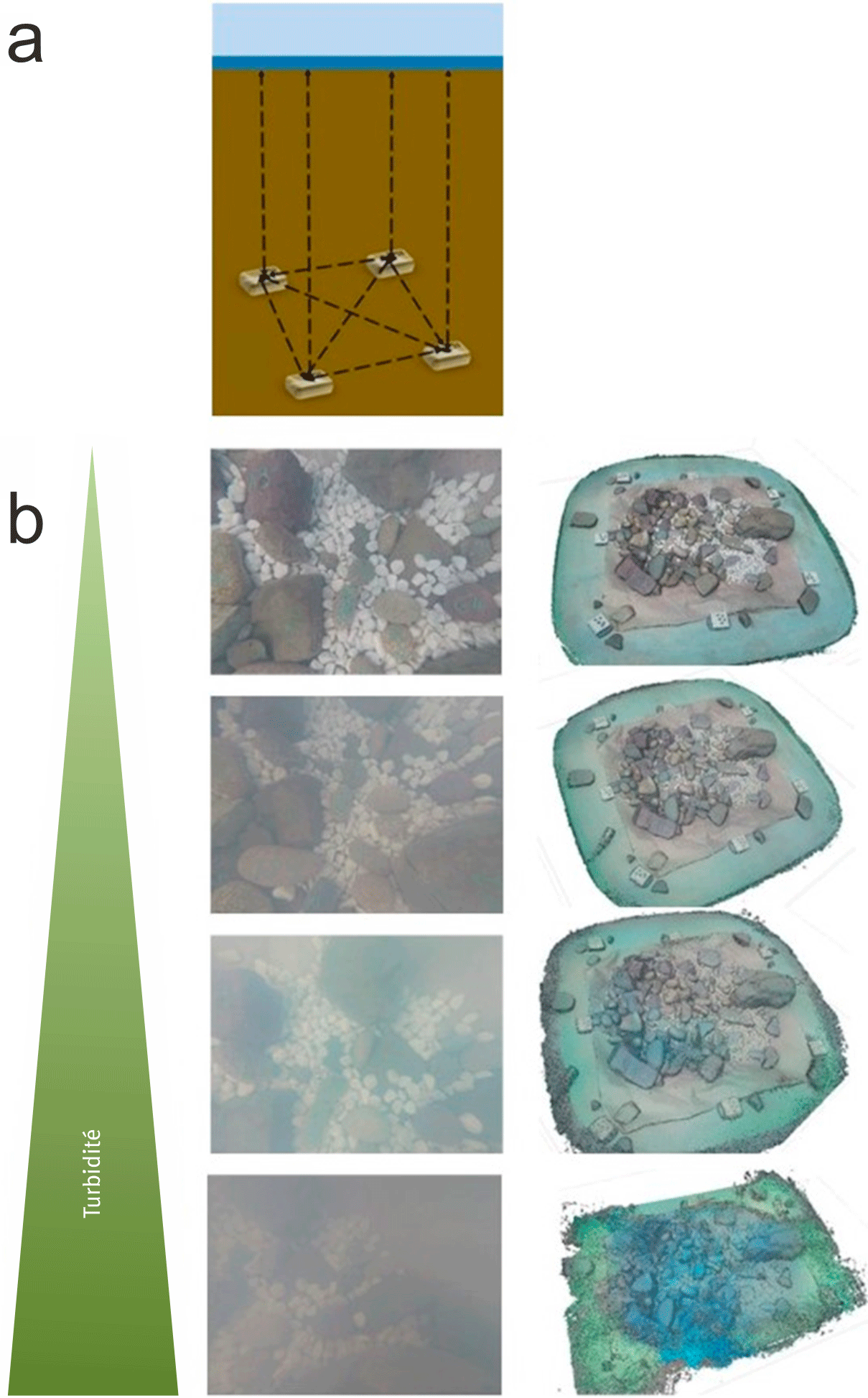
Pour pallier à ces deux contraintes principales (forte turbidité et faible hauteur d’eau), que l’on rencontre très fréquemment dans les cours d’eau, nous avons optimisé le protocole : toutes les photos subaquatiques sont prises à l’aide de cinq caméras GoPro fixées à un cadre carré flottant (figure 2a). Les quatre caméras en périphérie ont toutes un angle de 30° par rapport à la surface de l’eau, et sont tournées vers le centre du patch tandis que la cinquième caméra est située au centre du dispositif avec un angle de 90° (figure 2b). Pour reconstituer un nuage de points, il est nécessaire d’avoir un recouvrement entre deux photos consécutives d’au moins 60 %. Nous déplaçons le dispositif photographique en spirale autour du patch et ce à vitesse très lente, de l’extérieur du patch vers son centre, en prenant des photos toutes les deux secondes. L’analyse des variations des valeurs de hauteur d’eau (Z) au-dessus du substrat permet alors d’avoir une idée très précise de la microtopographie d’un habitat (figure 2c).

Premiers essais en rivière
Nous avons mis en place ce protocole dans différents cours d’eau et différents types d’habitats (figure 2d). L’objectif était principalement de vérifier la possibilité d’obtenir des nuages de points de patchs d’habitats in situ. Nous avons également fait varier la taille des patchs allant des plus petits (50 cm²) aux plus grands (15 m²). Les résultats obtenus (figure 3) montrent que la photogrammétrie est une technique tout à fait transposable aux milieux dulçaquicoles sous certaines conditions. Certains facteurs environnementaux sont en effet rédhibitoires pour la mise en œuvre de ce protocole : turbidité trop élevée, profondeurs trop faibles (< 10 cm), courants trop forts (beaucoup de bulles devant les objectifs), trop grande quantité de macrophytes en mouvement, luminosité insuffisante ou trop importante. Pour ce dernier cas, nous avons opté pour l’utilisation d’un dispositif d’ombrage afin d’homogénéiser les variations extérieures de luminosité (e.g., différentes couvertures végétales et nuageuses). Lorsque les conditions sont réunies, les nuages de points sont d’une précision qu’aucune autre technique ne peut égaler (figure 3).

Analyse des nuages 3D et descripteurs des habitats
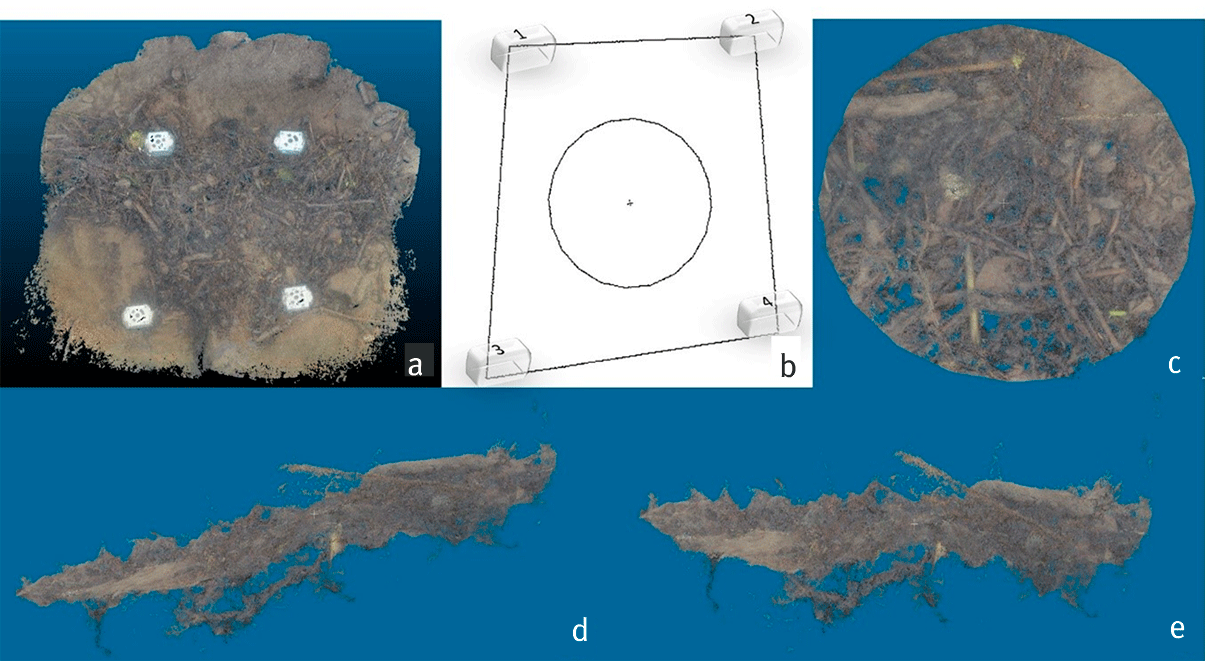
Sachant que la taille des patchs peut varier de manière significative selon la zone étudiée, la première étape des analyses des nuages de points consiste à standardiser la taille des nuages de points pour ensuite déterminer des descripteurs d’habitats qui puissent être comparables. Sur le nuage de points de l’ensemble du patch, nous sélectionnons donc uniquement une zone donnée dont la taille peut être adaptée selon les objectifs de l’étude. Ici, nous avons choisi de découper un cercle de 0,05 m² (figure 4). L’inclinaison naturelle du patch dans le cours d’eau peut amener à des variations de la hauteur (Z) du nuage qui ne sont en aucun cas liées à des variations de microtopographie de surface du substrat. C’est pourquoi nous avons projeté l’ensemble de nos nuages de points dans un plan horizontal et avons travaillé sur les valeurs projetées (Zp) des valeurs de hauteur d’eau (Z) au-dessus des éléments du substrat (figure 4). Enfin, les nuages générés peuvent présenter des variations importantes de densité des points : nous avons donc également standardisé la densité de tous les nuages de points à hauteur de 50 000 points (i.e., moyennes des Zp tous les approximativement 1 mm²).
Figure 4. Étapes de modification d’un nuage de points avant le calcul des descripteurs de microtopographie.
À partir des nuages de points standardisés, nous proposons de caractériser les variations de la microtopographie du substrat à l’aide de descripteurs statistiques et empiriques. Les descripteurs statistiques que nous avons choisis incluent la déviation standard (sd), la skewness (sk) et la kurtosis (k) de la distribution des Zp. La déviation standard nous donne des informations générales sur l’hétérogénéité de la surface du substrat de l’habitat, avec une faible sd représentant une faible hétérogénéité de la microtopographie. La skewness nous indique la présence de rares trous dans le substrat ou la présence de rares éléments grossier (e.g., un patch lisse avec seulement un caillou ou une branche). La kurtosis, de son côté, traduit la planarité de la surface : plus les Zp sont homogènes, plus k sera de forte valeur.
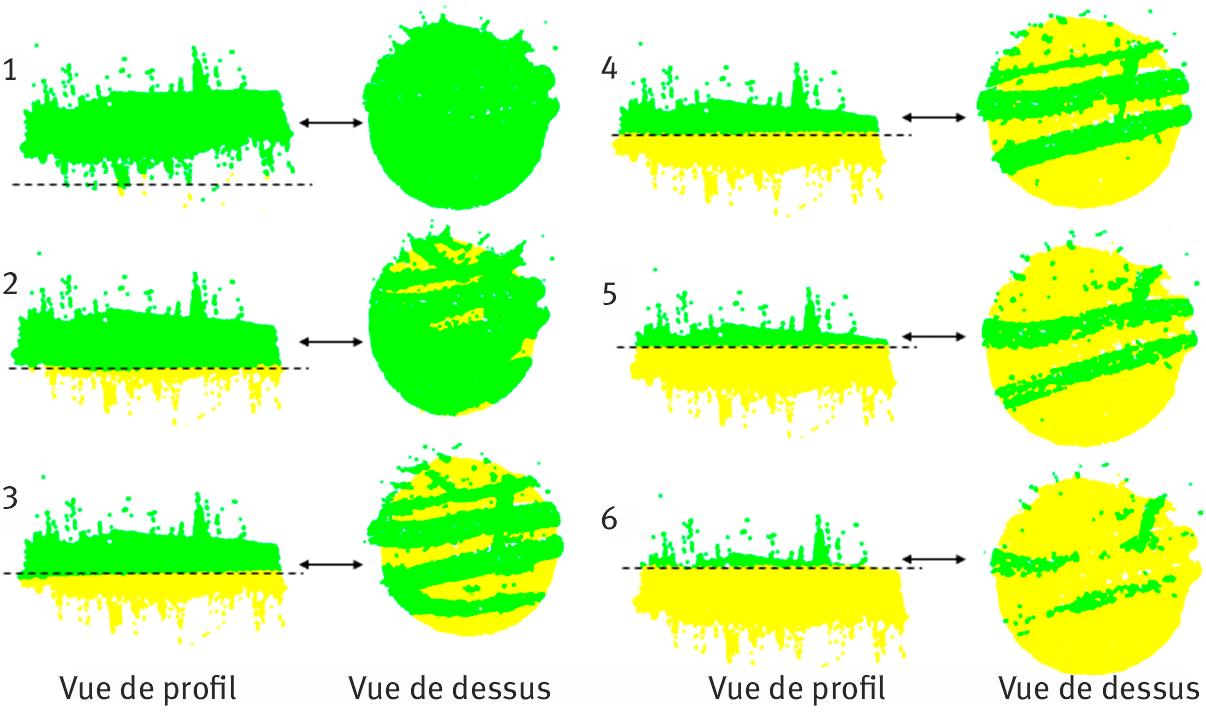
Les descripteurs empiriques incluent l’épaisseur et l’étendue surfacique moyenne des éléments grossiers identifiés (e.g., cailloux, branches) sur les patchs. Pour identifier ces éléments, nous avons réalisé des coupes transversales sur les nuages de points par tranches successives de 1 cm d’épaisseur en séparant par des couleurs différentes les points situés en dessous et au-dessus d’une coupe donnée (figure 5). Dès qu’une coupe donnée permet d’identifier des éléments saillants du substrat, les deux descripteurs empiriques peuvent être calculés (étape 3 ; figure 5). L’épaisseur moyenne du substrat de surface, un proxy du volume de chaque élément, correspond alors à la hauteur moyenne des Zp appartenant aux éléments grossiers déterminés ainsi (e.g., branches, cailloux ; points verts ; figure 5). A partir de ces découpes, nous avons également mesuré l’étendue surfacique de ces éléments identifiés — i.e., un proxy de l’espace occupé par ces éléments dans le patch — via la proportion des éléments identifiés (points verts) par rapport aux éléments non identifiés (points jaunes ; e.g., sable, petits cailloux, brindilles ; figure 5).
Figure 5. Exemple des six étapes de découpage d’un patch pour générer les descripteurs empiriques des variations du substrat.
Cas d’étude : les banquettes à ammocètes
Parmi les trois espèces de lamproies vivants dans les cours d’eau français, la lamproie marine (Petronmyzon marinus) est considérée comme étant en danger, tandis que la lamproie fluviatile (Lampetra fluviatilis) et la lamproie de planer (Lampetra planeri) sont classées en préoccupation mineure par l’Union internationale pour la conservation de la nature (IUCN, 2024). Ces espèces requièrent différents habitats spécifiques à chaque étape de leur cycle de vie mais peu de connaissances sont acquises sur le rôle de ces habitats, appelés « banquette(s) à ammocètes », qu’elles privilégient durant leur cycle larvaire. Alors que les lamproies adultes vont aller chercher des habitats lotiques à granulométrie grossière pour se reproduire, les larves utilisent, elles, des habitats à substrat mou composés essentiellement de sédiments fins (sableux ou limoneux) dans lesquels elles s’enfouissent pendant une longue période (jusqu’à sept ans) afin de poursuivre leur croissance (Dawson et al., 2015). Cependant, la description de ces habitats ne concerne généralement que le type de substrat (i.e. la granulométrie du substrat, avec une préférence pour les limons et sables), elle est le plus souvent qualitative, évaluée « à dire d’experts » et ne s’intéresse pas ou peu au substrat superficiel ni à la microtopographie de ces banquettes. Ce constat résulte en partie du fait que nous manquons de techniques standardisées pour caractériser ces types d’habitats. De plus, l’échantillonnage de ces habitats pour dénombrer les larves implique souvent des prélèvements de substrat et donc une forte perturbation de l’habitat (Lasne et al., 2010 ; Liedtke et al., 2021). Il est donc nécessaire de développer des techniques non invasives pour étudier ces habitats propices à ces espèces potentiellement menacées par les activités humaines.
Nous avons ainsi utilisé la technique de photogrammétrie comme une méthode innovante, non invasive et non destructive pour déterminer l’habitabilité des banquettes à ammocètes, et prédire leur présence dans ces habitats. Nous émettons l’hypothèse que le nuage de points permettra de mettre en évidence des variations de surface, représentatives de certains éléments du substrat (e.g. éléments organiques type feuilles ou branches, cailloux), qui peuvent être corrélées avec la présence des ammocètes dans les banquettes.
Notre étude s’est déroulée sur trois affluents de la Sélune, un fleuve côtier qui se jette dans la baie du Mont-Saint-Michel : l’Oir, le Beuvron et la Cance. Trois sites sont identifiés sur chaque cours d’eau, puis dix patchs par site sont sélectionnés et échantillonnés. Les banquettes sont sélectionnées visuellement depuis la rive sur la base de la vitesse de courant (zones de faibles courants propices au dépôt de sédiments fins recherchés par les ammocètes). En 2020, 30 patchs sur l’Oir et 10 patchs sur la Cance ont été échantillonnés. En 2021, l’ensemble des cours d’eau a été échantillonné (90 patchs), soit un total de 130 patchs pour toute l’étude. Suite à la prise d’images avec notre dispositif flottant (figure 2), nous avons prélevé les lamproies au centre de chaque patch à l’aide d’un filet troubleau de maille 500 µm couvrant une surface de prélèvement de 25 cm x 20 cm (0,05 m²). Pour ce faire, nous avons placé le filet au centre du patch et avons creusé à la main sur 5 à 10 cm de profondeur pour récupérer l’ensemble des larves de lamproies présentes dans le substrat. À l’aide d’un tamis, nous avons séparé les lamproies afin de les compter, les mesurer et les relâcher.
Sur la totalité des 130 patchs échantillonnés, 82 ont permis d’obtenir un nuage de points, soit 63 % de taux de succès (figure 6). Ce taux varie de 20 % à 100 % selon le site étudié. Les différentes banquettes étudiées présentaient des valeurs d’épaisseur de substrat superficiel très variées, allant de banquettes très lisses sans dépôt de matière organique avec principalement des dépôts sableux (épaisseur minimale = 0,57 cm) à des banquettes recouvertes de débris assez épais (épaisseur maximale = 16,6 cm). Sur l’ensemble de ces 82 patchs exploitables, 166 ammocètes ont été répertoriées avec une moyenne de 2,0 ± 3,7 (moyenne ± SD) et une abondance variant de 0 à 22 individus par patch. Parmi ces patchs, 37 ne présentaient aucune lamproie.

Notre modèle prédictif révèle un effet positif et significatif de l’épaisseur moyenne du substrat superficiel sur la présence des lamproies dans la banquette. La photogrammétrie nous a donc permis, sans destruction de l’habitat, de mesurer précisément les éléments de surface du substrat, composée principalement de débris de branches, brindilles, feuilles mortes et petits cailloux, et de révéler une corrélation avec la présence des ammocètes. Même si les études précédentes mettaient principalement en avant la composition du substrat et des types limon/sable comme favorisant l’enfouissement des ammocètes (Jazdzewski et al., 2015 ; Quintella et al., 2007), notre étude apporte un nouvel élément important à prendre en compte, à savoir que les ammocètes semblent préférer les banquettes présentant une couche superficielle épaisse composée majoritairement de débris organiques. Ces éléments offrent des conditions d’habitabilité adéquates (e.g. protection, ressources nutritives) pour le développement des juvéniles de lamproies (Goodwin et al., 2008). Des prospections supplémentaires dans d’autres rivières avec des conditions hydromorphologiques différentes sont cependant à prévoir pour généraliser ces résultats.
Perspectives sur la photogrammétrie subaquatique appliquée aux cours d’eau : un challenge prometteur
La photogrammétrie est de plus en plus utilisée pour l’étude des fonds marins ou d’objets immergés (e.g., épaves ; Abadie et al., 2018 ; Ventura et al., 2021). Cette technique est également employée pour étudier des habitats terrestres ou des portions de cours d’eau exondées (Bertin et Friedrich, 2016 ; Marteau et al., 2016). Toutefois, à notre connaissance, aucune étude n’a encore employé la photogrammétrie subaquatique pour étudier les habitats immergés des cours d’eau. Il y a en effet plusieurs contraintes imposées par ces milieux et auxquelles il faut faire face : la forte turbidité, la faible profondeur d’eau et la luminosité variable. Ces contraintes prises en compte (e.g., cinq caméras, ajout d’un dispositif d’ombrage), les premiers travaux réalisés dans cette étude mettent en évidence le potentiel de la photogrammétrie subaquatique pour l’étude des habitats d’espèces aquatiques. C’est une méthode rapide, facile à mettre en œuvre sur le terrain, et peu coûteuse comparée à d’autres méthode à haute définition (TLS, LIDAR). De plus, comparée à des méthodes plus classiques d’analyse des habitats sans imagerie, la photogrammétrie présente un gain de temps considérable et permet de s’affranchir de l’effet observateur. Elle permet d’évaluer, avec une précision millimétrique, le type de substrat dans un patch d’habitats sans avoir à le détruire par des prélèvements. De plus, les descripteurs des habitats que nous avons mesurés à partir des nuages de points semblent importants à prendre en compte pour comprendre l’occupation des habitats par les espèces, et notamment par les juvéniles de lamproies.
Bien que ces résultats soient prometteurs, d’autres développements permettront d’affiner le potentiel et les limites de la méthode. Une première piste que nous avons identifiée concerne l’utilisation de l’intelligence artificielle pour aider au développement de descripteurs d’habitats issus des nuages de points 3D (Letard et al., 2024). Les descripteurs empiriques que nous avons développés reflètent un compromis entre le temps de traitement et la qualité des éléments quantifiés dans le substrat (e.g., branches, cailloux). À l’inverse, des réseaux de neurones pourraient être entraînés à la reconnaissance automatique de ces éléments à partir des nuages 3D, ou au développement de nouveaux descripteurs pour améliorer le potentiel de la photogrammétrie. Une seconde piste consisterait à déployer la méthode dans d’autres environnements. En effet, les conditions environnementales entre les cours d’eau eux-mêmes peuvent être très différentes : présence plus ou moins importante de macrophytes, turbidité de l’eau (bassins agricoles), eau très claire mais à fort courant (torrents et rivières torrentiels). Une troisième piste viserait à appliquer la méthode à des patchs de plus grandes tailles. Car si la technique de photogrammétrie subaquatique est bien adaptée pour des études à l’échelle des micro-habitats, à des échelles plus larges (> 15 m2), les limites d’application de la technique sont inconnues. Cette piste permettrait d’appréhender d’autres processus plus larges influençant les organismes aquatiques (e.g., déplacements de banquettes à ammocètes suite aux activités agricoles ou aux grandes crues).
Bazin, A., Forget, G., Kreutzenberger, K., Dézerald, O. (2022). DUSTT : Déterminer l'utilisation du substrat par les migrateurs et les macroinvertébrés – Approches photogrammétrique subaquatique et multicritère. Rapport scientifique et technique final. OFB-Inrae- Institut Agro-UPPA. 32 p.
Photo d’entête : © Lightning Strike Pro (Adobe Stock)
Notes
- 1. Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services.
Références
- Abadie, A., Boissery, P., & Viala, C. (2018). Georeferenced underwater photogrammetry to map marine habitats and submerged artificial structures. The Photogrammetric Record, 33(164), 448-469. doi:10.1111/phor.12263
- Bertin, S., & Friedrich, H. (2016). Field application of close-range digital photogrammetry (CRDP) for grain-scale fluvial morphology studies. Earth Surface Processes And Landforms, 41(10), 1358-1369. doi:10.1002/esp.3906
- Dawson, H. A., Quintella, B. R., Almeida, P. R., Treble, A. J., & Jolley, J. C. (2014). The Ecology of Larval and Metamorphosing Lampreys. In: M. Docker (Eds.), Fish & Fisheries Series : Vol. 37, Lampreys: Biology, Conservation and Control. (pp. 75-137). doi:10.1007/978-94-017-9306-3_3
- Drap, P., Merad, D., Hijazi, B., Gaoua, L., Nawaf, M. M., Saccone, M., Chemisky, B., Seinturier, J., Sourisseau, J., Gambin, T., & Castro, F. (2015). Underwater Photogrammetry and Object Modeling : A Case Study of Xlendi Wreck in Malta. Sensors, 15(12), 30351-30384. doi:10.3390/s151229802
- Dudgeon, D., Arthington, A. H., Gessner, M. O., Kawabata, Z., Knowler, D. J., Lévêque, C., Naiman, R. J., Prieur-Richard, A., Soto, D., Stiassny, M. L. J., & Sullivan, C. A. (2005). Freshwater biodiversity : importance, threats, status and conservation challenges. Biological Reviews Of The Cambridge Philosophical Society, 81(2), 163-182. doi:10.1017/s1464793105006950
- Figueira, W., Ferrari, R., Weatherby, E., Porter, A., Hawes, S., & Byrne, M. (2015). Accuracy and Precision of Habitat Structural Complexity Metrics Derived from Underwater Photogrammetry. Remote Sensing, 7(12), 16883-16900. doi:10.3390/rs71215859
- Goodwin, C. E., Dick, J. T. A., Rogowski, D. L., & Elwood, R. W. (2008). Lamprey (Lampetra fluviatilis and Lampetra planeri) ammocoete habitat associations at regional, catchment and microhabitat scales in Northern Ireland. Ecology Of Freshwater Fish, 17(4), 542-553. doi:10.1111/j.1600-0633.2008.00305.x
- Heinrichs, J. A., Bender, D. J., & Schumaker, N. H. (2016). Habitat degradation and loss as key drivers of regional population extinction. Ecological Modelling, 335, 64-73. doi:10.1016/j.ecolmodel.2016.05.009
- IPBES. (2019). Global assessment report on biodiversity and ecosystem services of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services. Bonn: IPBS. doi:10.5281/zenodo.6417333
- IUCN Comité français, MNHN, SFI & AFB (2024). La Liste rouge des espèces menacées en France – Chapitre Poissons d’eau douce de France métropolitaine. Paris: IUCN.
- Jazdzewski, M., Marszał, L., & Przybylski, M. (2015). Habitat preferences of Ukrainian brook lamprey Eudontomyzon mariae ammocoetes in the lowland rivers of Central Europe. Journal Of Fish Biology, 88(2), 477-491. doi:10.1111/jfb.12806
- Lasne, E., Sabatié, M., Tremblay, J., Beaulaton, L., & Roussel, J. (2010). A new sampling technique for larval lamprey population assessment in small river catchments. Fisheries Research, 106(1), 22-26. doi:10.1016/j.fishres.2010.06.011
- Letard, M., Lague, D., & Corpetti, T. (2024). Extracting Optical and Physical Properties of Various Waters Using Lidar Waveforms and Deep Neural Networks. In IEE (Eds.), IGARSS 2024-2024 IEEE International Geoscience and Remote Sensing Symposium (pp. 6234-6237). Athens: IEE. doi:10.1109/IGARSS53475.2024.10642389
- Liedtke, T. L., Skalicky, J. J., & Weiland, L. K. (2021). Collection of larval lampreys (Entosphenus tridentatus and Lampetra spp.) using a portable suction dredge—A pilot test. USA: U.
- Lucas, M., Bubb, D., Jang, M., Ha, K., & Masters, J. (2009). Availability of and access to critical habitats in regulated rivers: effects of low-head barriers on threatened lampreys. Freshwater Biology, 54, 621-634. doi:10.1111/J.1365-2427.2008.02136.X
- Marteau, B., Vericat, D., Gibbins, C., Batalla, R. J., & Green, D. R. (2016). Application of Structure-from-Motion photogrammetry to river restoration. Earth Surface Processes And Landforms, 42(3), 503-515. doi:10.1002/esp.4086
- Quintella, B. R., Andrade, N. O., Dias, N. M., & Almeida, P. R. (2007). Laboratory assessment of sea lamprey larvae burrowing performance. Ecology Of Freshwater Fish, 16(2), 177-182. doi:10.1111/j.1600-0633.2006.00209.x
- Ventura, D., Mancini, G., Casoli, E., Pace, D. S., Lasinio, G. J., Belluscio, A., & Ardizzone, G. (2021). Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. Journal Of Environmental Management, 304, 114262. doi:10.1016/j.jenvman.2021.114262
- Westoby, M., Brasington, J., Glasser, N., Hambrey, M., & Reynolds, J. (2012). ‘Structure-from-Motion’ photogrammetry : A low-cost, effective tool for geoscience applications. Geomorphology, 179, 300-314. doi:10.1016/j.geomorph.2012.08.021
Résumé
La modification des habitats en cours d’eau est l'une des principales causes du déclin des espèces aquatiques. Cependant, la caractérisation précise, non invasive et non destructive de ces habitats est une tâche complexe et coûteuse en temps humain et matériel. Pour étudier les habitats, nous avons développé une approche innovante, non invasive et non destructive basée sur la photogrammétrie subaquatique consistant à quantifier rapidement, et de manière semi-automatique, les caractéristiques du substrat (e.g., microtopographie et taille des macro-éléments organiques ou minéraux). Nous avons réalisé des tests en milieux artificiels et naturels pour mettre au point cette technique, puis nous avons développé des descripteurs quantitatifs de l’habitat. Nous avons ensuite appliqué ce procédé à l’étude de l’écologie des larves de lamproies ou “ammocètes“. En effet, les ammocètes, potentiellement menacées par les activités humaines, ont besoin d'habitats spécifiques pour leur développement, mais les caractéristiques clés de ces habitats restent peu connues. Les résultats obtenus par photogrammétrie permettent une caractérisation millimétrique des variations de surface du substrat et apportent des éléments supplémentaires pour la compréhension de l’écologie des juvéniles de lamproie. Si des pistes d’amélioration peuvent être apportées, la photogrammétrie subaquatique est une technique prometteuse pour l’étude des habitats dans un contexte de forte anthropisation des cours d’eau.
Pas de document complémentaire pour cet article
Statistiques de l'article
 Vues: 6704
Vues: 6704
Téléchargements
 PDF: 149
PDF: 149
 XML: 36
XML: 36

